SERVICE DE CULTURES CELLULAIRES DE MAMMIFERES
Ce service est spécialisé dans le criblage cellulaire et l’analyse fonctionnelle pour détecter, analyser et quantifier des paramètres biologiques tels que la toxicité, la motilité cellulaire, le cycle cellulaire, l’apoptose et les voies de signalisation, dans des cellules cultivées adhérentes et non adhérentes (6 à 96 puits). La mission de ce service est de fournir un soutien technologique et scientifique à toute personne réalisant un projet nécessitant l'utilisation de lignées cellulaires de mammifères afin de caractériser les effets sur la bioactivité des extraits d'algues à des fins nutraceutiques et cosmétiques. Pour mener à bien sa mission, le service s’appuie sur un savoir-faire spécifique et sur une diversité de méthodes établies en fonctions des demandes des partenaires.
LE SAVOIR FAIRE
- Congélation des lignées cellulaires et décongélation
- Production de cellules : préparation de culots cellulaires pour l'analyse des protéines
- Transfection transitoire et stable
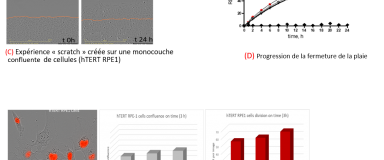
- Essai de cicatrisation « wound healing » (C)
- Acquisition d'images et génération de graphiques timelapse [système IncuCyte et ImageJ] (D)
- Etude de prolifération : : marquage nucléaire obtenu par le réactif Nuclight lentivirus avec mKate2 (protéine fluorescente rouge) (E)
Les méthodes
Les essais de bioactivités
- Viabilité : essai colorimétrique mesure l’activité mitochondriale des cellules vivantes
- Cytotoxicité : essai de luminescence mesure l’activité extracellulaire protéase des cellules mortes
- Immunomodulation : méthode de détection pro ou anti-inflammatoire basée sur l’activité luciferase du gène rapporteur Luc NF-κB [cellules colorectales recombinantes HT29]
- Stress oxydatif : essai de luminescence mesure le niveau du peroxide d’hydrogène (H2O2)
Les équipements
Le service de culture cellulaire d’une surface de15 m2 est dédié à la culture de lignées cellulaires établies et dispose de :
- 4 poste de sécurité microbiologique type II conforme à la norme NF EN 12469 – LNE
- 3 incubateurs à CO2
- 1 centrifugeuse
- 1 bain à billes d’acier “LabArmor heated ball baths”
- 1 électroporateur “Neon Transfection System”
- 1 microscope Olympus CKX41
- 2 lecteurs de microplaques en luminescence et en absorbance : Mithras 435 et Bioteck EL800
- 1 plateforme de pipetage Microlab NIMBUS (A)
- 1 système d’imagerie automatisé de cellules vivantes IncuCyte® S3 (B)